TIPOS DE DESTILADORES.
Generalidades.
Proceso que consiste en calentar un líquido hasta que sus componentes más volátiles pasan a la fase de vapor y, a continuación, enfriar el vapor para recuperar dichos componentes en forma líquida por medio de la condensación.
El objetivo principal de la destilación es separar una mezcla de varios componentes aprovechando sus distintas volatilidades, o bien separar los materiales volátiles de los no volátiles.
En la evaporación y en el secado, normalmente el objetivo es obtener el componente menos volátil; el componente más volátil, casi siempre agua, se desecha. Sin embargo, la finalidad principal de la destilación es obtener el componente más volátil en forma pura. Por ejemplo, la eliminación del agua de la glicerina evaporando el agua, se llama evaporación, pero la eliminación del agua del alcohol evaporando el alcohol se llama destilación, aunque se usan mecanismos similares en ambos caso. Se trata de un cambio de estado, por lo general, de líquido a gas, y posterior condensación para obtenerlos generalmente en su estado líquido.
En la industria alimentaria, la destilación ha sido y es utilizada para separar el alcohol de diversas frutas, granos, vinos y cervezas mayoritariamente sin embargo se obtiene por esta vía Aceites esenciales y gran cantidad de compuestos fuentes de sabores y aromas a bajo costo y con relativa rapidez.
Una vez que la materia prima (frutas, cereales, y otros materiales ricos en carbohidratos) ha fermentado a partir de un licor rico en azucares se calienta hasta la temperatura ebullición de trabajo del destilador, y la correspondiente para la etapa específica a una determinada altura en el destilador de cada uno de los diferentes componentes de base del material fermentado, tales como agua, alcohol y aceites que por sus características tienen diferentes puntos de ebullición, lo cual constituye el fundamento de la destilación como operación de transferencia de masa para la separación de los componentes individuales de una mezcla líquida.
El material destilado se recoge en recipientes para su ulterior purificación, mezcla o uso como producto final dependiendo de las características de calidad del obtenido en la destilación, cuidando que los producto cabeza y cola (elementos indeseables) están excluidos del producto principal como por ejemplo el alcohol etílico y sus productos de cabeza más volátiles como el metanol o de cola como alcoholes de alto peso molecular menos volátiles.
Si la diferencia en volatilidad (y por tanto en punto de ebullición) entre los dos componentes es grande, puede realizarse fácilmente la separación completa en una destilación individual. El agua del mar, por ejemplo, que contiene un 4% de sólidos disueltos (principalmente sal común), puede purificarse fácilmente evaporando el agua, y condensando después el vapor para recoger el producto: agua destilada. Para la mayoría de los propósitos, este producto es equivalente al agua pura, aunque en realidad contiene algunas impurezas en forma de gases disueltos, siendo la más importante el dióxido de carbono.
Si los puntos de ebullición de los componentes de una mezcla sólo difieren ligeramente, no se puede conseguir la separación total en una destilación individual. Un ejemplo importante es la separación de agua, que hierve a 100 °C, y alcohol, que hierve a 78,5 °C. Si se hierve una mezcla de estos dos líquidos, el vapor que sale es más rico en alcohol y más pobre en agua que el líquido del que procede, pero no es alcohol puro. Con el fin de concentrar una disolución que contenga un 10% de alcohol (como la que puede obtenerse por fermentación) para obtener una disolución que contenga un 50% de alcohol (frecuente en el whisky), el destilado ha de destilarse una o dos veces más, y si se desea alcohol industrial (95%) son necesarias varias destilaciones.
En la mezcla simple de dos líquidos solubles entre sí, la volatilidad de cada uno es perturbada por la presencia del otro. En este caso, el punto de ebullición de una mezcla al 50%, por ejemplo, estaría a mitad de camino entre los puntos de ebullición de las sustancias puras, y el grado de separación producido por una destilación individual dependería solamente de la presión de vapor, o volatilidad de los componentes separados a esa temperatura.
Esta sencilla relación fue anunciada por vez primera por el químico francés François Marie Raoult (1830-1901) y se llama ley de Raoult. Esta ley sólo se aplica a mezclas de líquidos muy similares en su estructura química, como el benceno y el tolueno. En la mayoría de los casos se producen amplias desviaciones de esta ley. Si un componente sólo es ligeramente soluble en el otro, su volatilidad aumenta anormalmente.
En el ejemplo anterior, la volatilidad del alcohol en disolución acuosa diluida es varias veces mayor que la predicha por la ley de Raoult. En disoluciones de alcohol muy concentradas, la desviación es aún mayor: la destilación de alcohol de 99% produce un vapor de menos de 99% de alcohol. Por esta razón el alcohol no puede ser concentrado por destilación más de un 97%, aunque se realice un número infinito de destilaciones.
Clases de Destilación
Ø Destilación fraccionada: Si se consigue que una parte del destilado vuelva del condensador y gotee por una larga columna a una serie de platos, y que al mismo tiempo el vapor que se dirige al condensador burbujee en el líquido de esos platos, el vapor y el líquido interaccionarán de forma que parte del agua del vapor se condensará y parte del alcohol del líquido se evaporará. Así pues, la interacción en cada plato es equivalente a una redestilación, y construyendo una columna con el suficiente número de platos, se puede obtener alcohol de 95% en una operación individual. Además, introduciendo gradualmente la disolución original de 10% de alcohol en un punto en mitad de la columna, se podrá extraer prácticamente todo el alcohol del agua mientras desciende hasta la placa inferior, de forma que no se desperdicie nada de alcohol.
Este proceso, conocido como rectificación o destilación fraccionada, se utiliza mucho en la industria alimentaria, no sólo para mezclas simples de dos componentes (como alcohol y agua en los productos de fermentación, u oxígeno y nitrógeno en el aire líquido), sino también para mezclas más complejas.
La columna de fraccionamiento que se usa con más frecuencia es la llamada torre con caperuzas de burbujeo, en la que las platos están dispuestas horizontalmente, separadas unos centímetros, y los vapores ascendentes suben por unas caperuzas de burbujeo a cada plato, donde burbujean a través del líquido.
Los platos están escalonados de forma que el líquido fluye de izquierda a derecha en una placa, luego cae a la placa de abajo y allí fluye de derecha a izquierda. La interacción entre el líquido y el vapor puede ser incompleta debido a que puede producirse espuma y arrastre de forma que parte del líquido sea transportado por el vapor a la placa superior. En este caso, pueden ser necesarios cinco platos para hacer el trabajo de cuatro platos teóricas, que realizan cuatro destilaciones.
Un equivalente barato de la torre de burbujeo es la llamada columna apilada, en la que el líquido fluye hacia abajo sobre una pila de anillos cerámicos o retal de tuberías de vidrio.
La única desventaja de la destilación fraccionada es que una gran fracción llamada el reflujo (más o menos la mitad) del destilado condensado debe volver a la parte superior de la torre y eventualmente debe hervirse otra vez, con lo cual hay que suministrar más calor. Por otra parte, el funcionamiento continuo permite grandes ahorros de calor, porque el destilado que sale puede ser utilizado para precalentar el material que entra.
Cuando la mezcla está formada por varios componentes, estos se extraen en distintos puntos a lo largo de la torre. Las torres de destilación industrial para petróleo tienen a menudo 100 platos, con al menos diez fracciones diferentes que son extraídas en los puntos adecuados. Se han utilizado torres de más de 500 platos para separar isótopos por destilación.
Ø Destilación por arrastre con vapor: Si dos líquidos insolubles se calientan, y si ninguno de los dos es afectado por la presencia del otro (mientras se les remueva para que el líquido más ligero no forme una capa impenetrable sobre el más pesado) y se evaporan en un grado determinado solamente por su propia volatilidad. Por lo tanto, dicha mezcla siempre hierve a una temperatura menor que la de cada componente por separado. El porcentaje de cada componente en el vapor sólo depende de su presión de vapor a esa temperatura. Este principio puede aplicarse a sustancias que podrían verse perjudicadas por el exceso de calor si fueran destiladas en la forma habitual.
En este caso al contacto del material a destilas disminuye la presión parcial de cada componente y por lo tanto su temperatura de destilación, y por consiguiente se hace relativamente sencilla la destilación de los componentes
Ø Destilación al vacío: Otro método para destilar sustancias a temperaturas por debajo de su punto normal de ebullición es evacuar parcialmente el alambique. Por ejemplo, la anilina puede ser destilada a 100 °C extrayendo el 93% del aire del alambique. Este método es tan efectivo como la destilación por arrate con vapor, pero más costoso. Cuanto mayor es el grado de vacío, menor es la temperatura de destilación. Si la destilación se efectúa en un vacío prácticamente perfecto, el proceso se llama destilación molecular. Este proceso se usa normalmente en la industria para purificar vitaminas y otros productos inestables. Se coloca la sustancia en una placa dentro de un espacio evacuado y se calienta. El condensador es una placa fría, colocada tan cerca de la primera como sea posible. La mayoría del material pasa por el espacio entre los dos platos, y por lo tanto se pierde muy poco.
Ø Destilación molecular centrífuga: Si una columna larga que contiene una mezcla de gases se cierra herméticamente y se coloca en posición vertical, se produce una separación parcial de los gases como resultado de la gravedad. En una centrifugadora de alta velocidad, o en un instrumento llamado vórtice, las fuerzas que separan los componentes más ligeros de los más pesados son miles de veces mayores que las de la gravedad, haciendo la separación más eficaz.
Ø Sublimación: Si se destila una sustancia sólida, pasándola directamente a la fase de vapor y otra vez a la fase sólida sin que se forme un líquido en ningún momento, el proceso se llama sublimación. La sublimación no difiere de la destilación en ningún aspecto importante, excepto en el cuidado especial que se requiere para impedir que el sólido obstruya el aparato. La rectificación de dichos materiales es imposible.
Ø Destilación destructiva: Cuando se calienta una sustancia a una temperatura elevada, descomponiéndose en varios productos valiosos, y esos productos se separan por fraccionamiento en la misma operación, el proceso se llama destilación destructiva. Las aplicaciones más importantes de este proceso son la destilación destructiva del carbón para la obtención del coque, el alquitrán, el gas y el amoníaco, y la destilación destructiva de la madera para la producción de carbón de leña, Acido Etanoico, la Propanona y el Metanol. Este último proceso ha sido ampliamente desplazado por procedimientos sintéticos para fabricar distintos subproductos. El craqueo del petróleo se asemeja a una destilación destructiva.








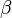 -caroteno natural es transformado en Vitamina A en la mucosa del intestino delgado, y ésta es almacenada principalmente en el hígado en forma de ésteres de retinol. El
-caroteno natural es transformado en Vitamina A en la mucosa del intestino delgado, y ésta es almacenada principalmente en el hígado en forma de ésteres de retinol. El 


