REALIZACIÓN DEL FROTIS
1.
Colocar
una pequeña gota de agua en el centro de un portaobjetos limpio. Es necesaria
muy poca cantidad de agua, por lo que se puede usar el asa de siembra, ya que
en el extremo curvo de su filamento queda retenida una mínima gota de agua, que
resulta suficiente.
2.
Flamear
el asa de siembra, tomar, en condiciones asépticas, una pequeña cantidad del
cultivo bacteriano en medio sólido y transferirlo a la gota de agua. Remover la
mezcla con el asa de siembra hasta formar una suspensión homogénea que quede
bastante extendida para facilitar su secado.
Si la muestra se toma de un cultivo en medio líquido, no es necesario realizar los dos primeros pasos ya que basta con colocar y extender una gota de la suspensión bacteriana, que se toma con el asa de siembra, directamente sobre el portaobjetos.
Si la muestra se toma de un cultivo en medio líquido, no es necesario realizar los dos primeros pasos ya que basta con colocar y extender una gota de la suspensión bacteriana, que se toma con el asa de siembra, directamente sobre el portaobjetos.
3.
Esperar
hasta que el líquido se evapore o acelerar su evaporación acercando el porta a
la llama del mechero. En este caso hay que tener mucha precaución de no
calentar demasiado el porta pues las células pueden deformarse o romperse.
FIJACIÓN DE LAS BACTERIAS AL PORTAOBJETOS
4.
Por
calor: Pasar cinco veces el portaobjetos por la llama durante unos segundos.
Dejar enfriar el porta entre los pases.
Una vez realizado
el frotis y fijadas las bacterias, las preparaciones pueden ser observadas al
microscopio, aunque carecen de contraste. Lo normal es continuar con el proceso
de tinción.
TINCIÓN DEL FROTIS BACTERIANO
5.
Cubrir
el frotis con abundante colorante y dejarlos actuar durante el tiempo que
indique el protocolo de cada tinción concreta. Suele oscilar entre 1 y 5
minutos. En ocasiones el colorante tiñe sólo en caliente, por lo que el tiempo
que dure su actuación se deberá sostener el portaobjetos con unas pinzas sobre
la llama del mechero para que humee el colorante, pero teniendo mucho cuidado
de que no llegue a hervir ya que se produciría la destrucción de las células.
6.
Lavar
la preparación con agua para eliminar el colorante. Esta operación se realiza
inclinando el portaobjetos y aplicando el chorro de agua en su parte superior
de manera que resbale sobre el frotis, pero sin que vaya dirigido directamente
sobre él, pues podría arrastrar parte del frotis consigo. Eliminar la máxima
cantidad de agua de los portaobjetos golpeándolos con cuidado contra la
superficie de la mesa de trabajo.
7.
Secar
el portaobjeto: en ningún caso se debe frotar el portaobjeto.
Observar la
preparación al microscopio llegando hasta el máximo aumento. Si se quiere
montar de forma definitiva no se debe usar ahora el aceite de inmersión.








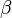 -caroteno natural es transformado en Vitamina A en la mucosa del intestino delgado, y ésta es almacenada principalmente en el hígado en forma de ésteres de retinol. El
-caroteno natural es transformado en Vitamina A en la mucosa del intestino delgado, y ésta es almacenada principalmente en el hígado en forma de ésteres de retinol. El 

